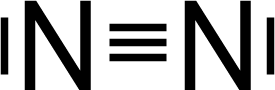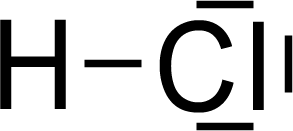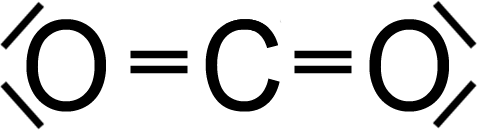Atombindung
Inhalt
Elektronenpaare
Atombindung
Durch Atombindung können sehr unterschiedliche Stoffe entstehen. Diamanten (), die ein Atomgitter aus undefiniert vielen C-Atomen ausbilden, sind ebenso wie Wasserstoff (), Wasser () oder Fruchtzucker (), die sich in genau definierter Atomanzahl zu Molekülen verbinden, dieser Bindungsart zugehörig. Der Aggregatzustand eines Molekülverbands ist abhängig von der Größe sowie der Anziehungskraft zwischen den beteiligten Molekülen. Ob ein Molekülverband wasserlöslich ist oder nicht, ist abhängig von der Polarität der Moleküle. Nur eine Eigenschaft haben alle durch Atombindung zustande gekommenen Stoffe gemein: Sie sind Isolatoren; alle Elektronen sind fest gebunden, kein elektrischer Strom kann fließen.
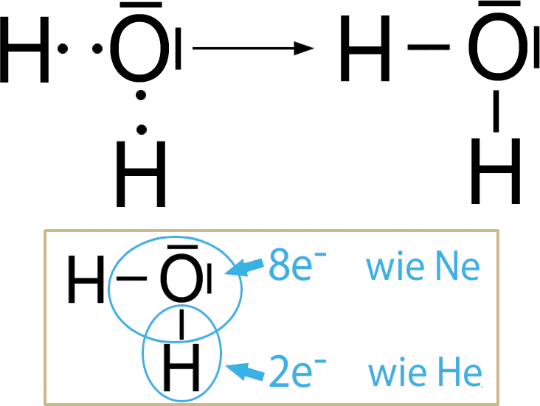
 Die Atombindung wird auch Elektronenpaarbindung genannt. Die Bindung kommt dadurch zustande, dass Nichtmetallatome Valenzelektronen für eine Elektronenpaarung bereitstellen. Dabei lagert sich von jedem Atom ein Valenzelektron zu einem gemeinsamen Elektronenpaar zusammen. Dieses bindende Elektronenpaar befindet sich zwischen den Atomen, hält sie zusammen und gehört beiden Atomen.
Die Atombindung wird auch Elektronenpaarbindung genannt. Die Bindung kommt dadurch zustande, dass Nichtmetallatome Valenzelektronen für eine Elektronenpaarung bereitstellen. Dabei lagert sich von jedem Atom ein Valenzelektron zu einem gemeinsamen Elektronenpaar zusammen. Dieses bindende Elektronenpaar befindet sich zwischen den Atomen, hält sie zusammen und gehört beiden Atomen.
Sind die Atome vom gleichen Element, wird das bindende Elektronenpaar von beiden Atomen gleich stark angezogen. Ein unpolares Molekül entsteht (z. B. ). Sind die Atome von unterschiedlichen Elementen, kann das bindende Elektronenpaar von einem Atom stärker angezogen werden als vom anderen Atom. Zieht, so wie bei HF, das F-Atom das gemeinsame Elektronenpaar stärker an als das H-Atom, so kommt es zu einer ungleichmäßigen Elektronenverteilung.  Das F-Atom wird etwas negativer geladen und erhält eine negative Teilladung, δ– (bezeichnet mit dem griechischen Buchstaben delta). Das H-Atom wird entsprechend positiver geladen und bekommt eine positive Teilladung, δ. Ein polares Molekül, auch Dipolmolekül (Zweipolmolekül) genannt, kann bei entsprechender Molekülstruktur entstehen.
Das F-Atom wird etwas negativer geladen und erhält eine negative Teilladung, δ– (bezeichnet mit dem griechischen Buchstaben delta). Das H-Atom wird entsprechend positiver geladen und bekommt eine positive Teilladung, δ. Ein polares Molekül, auch Dipolmolekül (Zweipolmolekül) genannt, kann bei entsprechender Molekülstruktur entstehen.
Entscheide, bei welcher der gegebenen Verbindungen es sich auf jeden Fall um ein unpolares Molekül handelt.
Begründe!
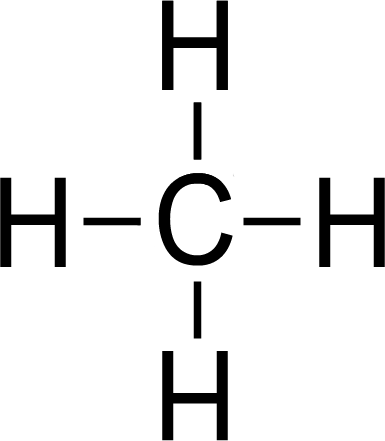
CH₄
… weil?
N₂
… weil?
HCl
… weil?
H₂O
… weil?
CO₃
… weil?
NH₃
… weil?
Nichtbindende Elektronenpaare
Elektronenpaare, bindende wie auch nichtbindende, stoßen einander durch ihre negative Ladung ab. Sie sind so um ein Atom angeordnet, dass sie einen möglichst großen Abstand voneinander haben. Nichtbindende Elektronenpaare haben zudem einen wesentlich größeren Raumbedarf – sie sind nur im Einflussbereich eines Atoms.
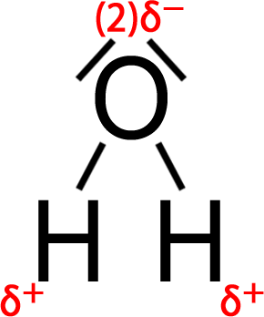 Nichtbindende Elektronenpaare können für die räumliche Struktur von Molekülen von großer Bedeutung sein. Wasser hat aufgrund der nichtbindenden Elektronenpaare am Sauerstoff beispielsweise eine gewinkelte Molekülstruktur und ist deshalb ein Dipolmolekül. Das wirkt sich auch auf die Kräfte zwischen den Wassermolekülen aus (siehe Kapitel 5.3).
Nichtbindende Elektronenpaare können für die räumliche Struktur von Molekülen von großer Bedeutung sein. Wasser hat aufgrund der nichtbindenden Elektronenpaare am Sauerstoff beispielsweise eine gewinkelte Molekülstruktur und ist deshalb ein Dipolmolekül. Das wirkt sich auch auf die Kräfte zwischen den Wassermolekülen aus (siehe Kapitel 5.3).
Ermittle die drei Dipolmoleküle.
Begründe deine Entscheidung.

Begründung:

Begründung:
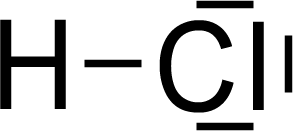
Begründung:
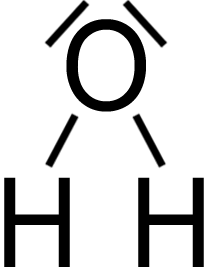
Begründung:
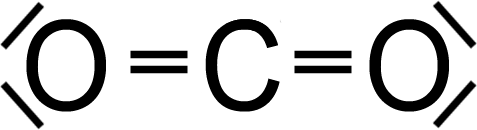
Begründung:
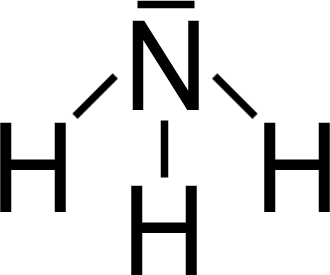
Begründung:
Elektronenpaarbindung
Valenzstrichschreibweise
Die Valenzelektronen der Nichtmetallatome können in der Valenzstrichschreibweise folgendermaßen geschrieben werden: Man schreibt das Elementsymbol des gesuchten Elements an, findet heraus, wie viele Valenzelektronen es hat, und schreibt diese Elektronen mit Punkten und Strichen rund um das Elementsymbol an. Zuerst werden alle vier Seiten um das Symbol mit je einem Elektron besetzt (ein Punkt steht für ein Valenzelektron), durch Doppelbesetzung ergeben sich Elektronenpaare (ein Strich steht für ein Elektronenpaar).

Zeichne alle Nichtmetalle in der Valenzstrichschreibweise auf.
Bindung erzeugt den energetisch günstigsten und damit stabilsten Zustand
Sollen sich Nichtmetallatome zu einem Molekül verbinden, dann kann man das am Papier so machen, wie es auch die Natur macht: Gesucht ist immer die einfachste Lösung. Diese entspricht dem energetisch günstigsten und damit stabilsten Zustand.
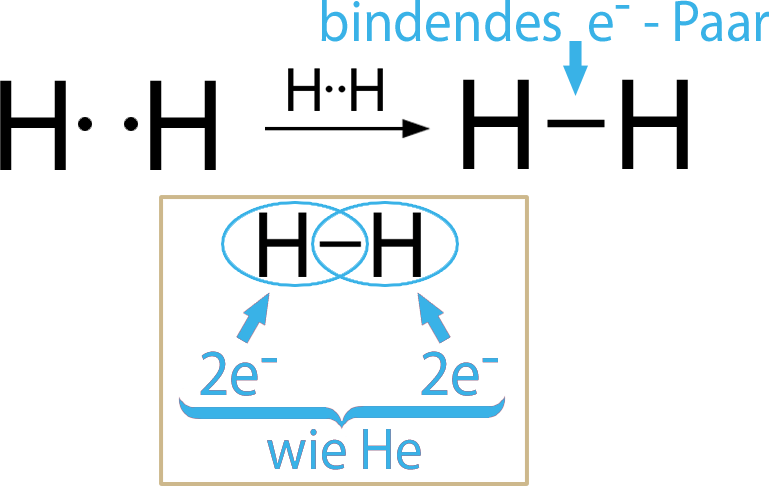
Wenn sich beispielsweise H-Atome miteinander verbinden, dann entsteht . Etwas anderes wäre hier gar nicht möglich. Durch das bindende Elektronenpaar, das beiden Partnern gehört, ist jeder Wasserstoff im Edelgaszustand.
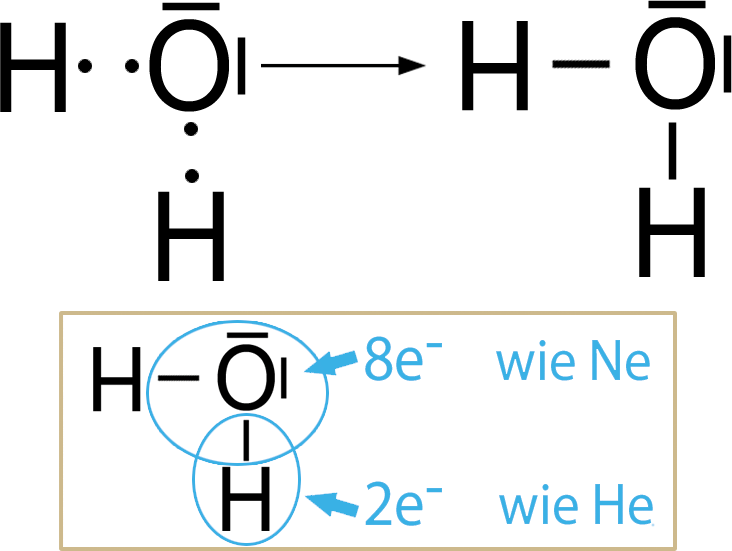
Wenn sich H- und O-Atome miteinander verbinden, dann entsteht . Möglich wären hier auch 2 H- und 2 O-Atome, die eine Bindung eingehen; aber ätzendes (Wasserstoffperoxid) entsteht natürlicherweise eher nicht (Ausnahme: Bombardierkäfer produzieren es zur Verteidigung).
Gib die Strukturformeln in Valenzstrichschreibweise an.
Gib die Strukturformeln von und in der Valenzstrichschreibweise an.
Training
Lückentext
Drucke das PDF aus und ergänze die Grafiken der Strukturformeln, sodass für jedes Molekül die Edelgasregel erfüllt ist.
Summenformel eines Moleküls
Die Summenformel eines Moleküls muss für anorganische Moleküle auswendig gelernt werden; es gibt hier keine Regeln.
Für die Summenformeln von organischen Molekülen hingegen sind folgende Regeln zu beachten: Zuerst muss der Kohlenstoff (C) genannt werden, dann der Wasserstoff (H); sollten noch andere Elemente vorkommen, so sind sie in alphabetischer Reihenfolge zu nennen (Elementsymbole!).
Suche jeweils den/die Fehler. Stelle die Summenformel richtig und begründe deine Entscheidung.
Info: Sofern dein Browser moderne Schriftsätze unterstützt, erscheinen Zahlen, die du in die Formel-Felder eingibst, automatisch tiefgestellt.
| Gegebene Summenformel | Richtige Summenformel | Begründung |
|---|---|---|
| H12O6C6 | ||
| H10C4 | ||
| C2Cl2H4 | ||
| C2H5OH | ||
| C3H7SO2N |
Merke
Elektronenpaarbindung – Zusammenfassung
Gehen Nichtmetallatome eine Bindung ein, so entstehen bindende Elektronenpaare, die beiden Partnern zugehörig sind. Sind in einem Molekül nur gleiche Nichtmetallatome, so entstehen unpolare Moleküle. Sind in einem Molekül verschiedene Nichtmetallatome, können, je nach Molekülstruktur, unpolare Moleküle oder Dipolmoleküle entstehen.