Chemische Bindungen
Inhalt
Gründe für Bindungen
Alle Elemente streben einen stabilen Zustand an
Wir kennen heute Millionen verschiedener Stoffe, obwohl es in der Natur nur etwa 90 Elemente gibt. Die meisten Stoffe bestehen zudem aus verschiedenen Elementen. Die Atome eines jeden Elements streben immer danach, einen möglichst stabilen Zustand zu erreichen. Atome, deren äußere Schale mit Elektronen aufgefüllt ist, sind besonders stabil. Eine volle Außenschale haben die Edelgase, wie Argon im nebenstehenden Bild. Sie sind stabil und die einzigen Elemente, die nur als einzelne Atome vorkommen. Alle anderen Elemente streben diesen stabilen Zustand der Edelgase (Edelgaszustand) an und wollen ihre äußerste Schale mit Elektronen auffüllen.

Argon

Neonbeleuchtung
Suche im Periodensystem die Edelgase Argon, Helium und Neon und beantworte folgende Fragen:
Wie viele Elektronen haben diese Elemente?
Wie viele ihrer Elektronen befinden sich in der jeweils äußersten Schale?
Valenzelektronen
Die einzelnen Schalen der Elektronenhüllen können unterschiedlich viele Elektronen beinhalten, aber es können immer nur höchstens acht dieser Elektronen Valenzelektronen sein (dies hat energetische Gründe). Die Anzahl der Valenzelektronen kann man von Hauptgruppenelementen (Gruppen 1, 2, 13 bis 18) leicht ablesen, da die Einerstelle der Gruppennummer die Anzahl der Valenzelektronen angibt. Bei den anderen Elementen ist es leider nicht so einfach.
Finde anhand des Periodensystems heraus, …
… wie viele Valenzelektronen wie viele Valenzelektronen die Elemente Kalium, Aluminium, Stickstoff, Iod und Blei haben.
… wie viele Valenzelektronen den Elementen Lithium, Aluminium, Sauerstoff, Wasserstoff, Helium, Phosphor und Chlor zum Edelgaszustand fehlen
3 Möglichkeiten, um den Edelgaszustand zu erreichen
Um den Edelgaszustand zu erreichen, gibt es drei Möglichkeiten. Die Atome können Valenzelektronen aufnehmen oder abgeben oder für eine Elektronenpaarung bereitstellen. Es kommt darauf an, ob ein Atom ein Metall- oder ein Nichtmetallatom ist (Halbmetallatome können nicht so genau zugeordnet werden, ihr Verhalten ändert sich je nach Reaktionspartner). Metallatome können Valenzelektronen nur abgeben. Nichtmetallatome können Valenzelektronen aufnehmen oder für eine Elektronenpaarung bereitstellen.
Finde heraus, welche Elemente Valenzelektronen abgeben können.
Bindungsarten
Bindungsarten
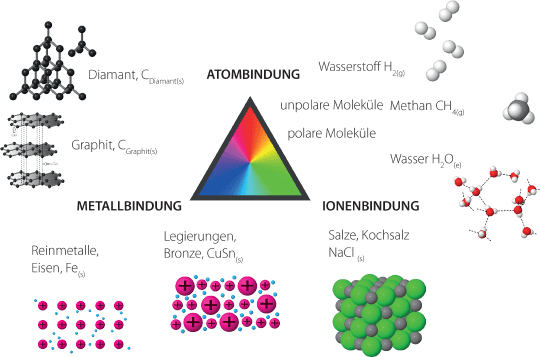
Es gibt drei Bindungsarten (Teilchenverbände):
- Die Atombindung: Aus gleichen Nichtmetallen entstehen Atomgitter oder unpolare Moleküle. Aus verschiedenen Nichtmetallen entstehen unpolare oder polare Moleküle.
- Die Ionenbindung: Aus Nichtmetallen und Metallen entstehen Salze.
- Die Metallbindung: Aus gleichen Metallen entstehen Reinmetalle. Aus verschiedenen Metallen entstehen Legierungen.
Diese Bindungsarten bilden die Grenzformen. Dazwischen gibt es fließende Übergänge – etwa wenn Halbmetalle wie Si beteiligt sind. Es kommt zu Abweichungen von den typischen Merkmalen einer Bindungsart. Paradebeispiel hierfür ist CGraphit. Durch spezielle Anordnung der C im Atomgitter des Graphits zeigt die Nichtmetallverbindung elektrische Leitfähigkeit, die eigentlich eine typisch metallische Eigenschaft ist.
Die chemische Formel einer Verbindung beschreibt die kleinstmögliche Einheit der Teilchenverbände. Der Aggregatzustand kann hinter der Formel angegeben sein: gasförmig(g), flüssig(l), fest(s).
Besprecht, welche Bindungsart folgende Verbindungen miteinander eingegangen sind.

Natrium
Na

Aluminiumoxid
Al2O3

Stickstoff
N2

Ethanol
C2H6O

Messing
CuZn
Training
Leitfähigkeit von Lösungen

Stelle drei Lösungen mit je einem Löffel Kochsalz (NaCl), Speisesoda (NaHCO3), Kartoffelstärke (C6H10O6) und Traubenzucker (C6H12O6) her. Notiere deine Vermutung, welche Lösung den elektrischen Strom leitet. Teste deine Vermutung mithilfe eines Experiments. Plane das Experiment und erstelle eine Materialliste. Besprich dein Experiment mit deiner Lehrkraft und führe es durch. Vergleiche dein Experiment und die erhobenen Daten mit einer Mitschülerin, einem Mitschüler.
Meine Vermutung:
Experiment:
Materialliste:
Beobachtung:
Anmerkungen:
Schmelzprobe
Vorlage für Versuchsprotokolle
Vorlage_f_r_Versuchsprotokolle_Chemie.docx · 16 kB
Du benötigst zwei Verbrennungslöffel. In den einen gibst du einen Spatel voll Kochsalz und in den anderen einen Spatel Zucker. Erhitze die beiden Proben gleichzeitig mit einem Brenner und notiere jede Veränderung der beiden Proben. Fertige ein Versuchsprotokoll mithilfe der Vorlage an.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.

Lies die Sprechblasen genau.
Überlege, wer recht hat. Begründe deine Vermutung. Schreibe zusätzlich eine kurze Übersicht der Bindungsarten.
„Schau dir die rostigen Autos an. In Chemie haben wir gehört, dass Rost chemisch gesehen ein Salz ist.“
Begründung:
„Rost soll ein Salz sein, Salz ist doch weiß und Rost besteht aus Eisen, ist also ein Metall.“
Begründung:
„Das Blech besteht aus Stahl, also einer Legierung, und an den Stellen, die rostig sind, hat sich das Eisen vom Stahl mit Sauerstoff verbunden.“
Begründung:
„Wenn ein Nichtmetall wie Sauerstoff in der Verbindung steckt, ist es dann nicht die Atombindung, Moleküle und so?“
Begründung:
Welche Elemente verbinden sich (Metalle, Nichtmetalle)?
Nenne die Namen der entstandenen Verbindungen.
Alle gegebenen Elemente streben den Edelgaszustand an.
Wie können sie ihn erreichen? Ergänze!
Verwende die Elementsymbole!
O₂
Na₂O
HCl
Mg
CO₂
CuZn
CaCl₂
CH₃F
CuSn
Merke
Bindungsarten – Zusammenfassung
Durch chemische Bindung versuchen Atome einen möglichst stabilen Zustand (Edelgaszustand) zu erreichen. Es gibt hierfür drei Möglichkeiten. Valenzelektronen können aufgenommen oder abgegeben oder für eine Elektronenpaarung bereitgestellt werden.