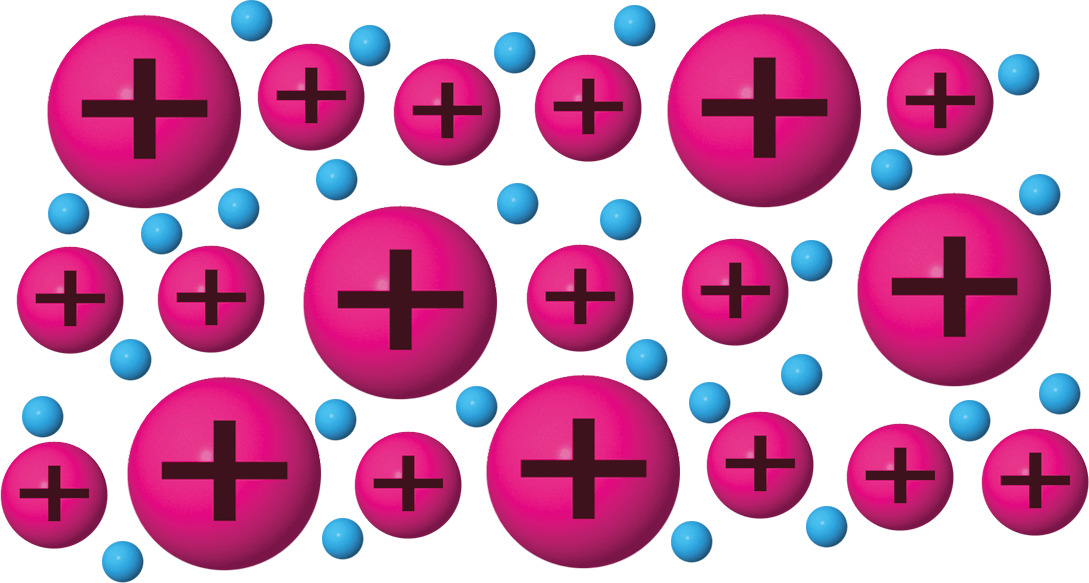Metallbindung
Inhalt
Reinmetalle
Entstehung von Metallen
Verbinden sich nur gleiche Metallatome miteinander, so entstehen (Rein-) Metalle. Sie weisen einige typische Eigenschaften auf. Sie sind bei Raumtemperatur fast immer fest, haben meist einen metallischen Glanz, sind leicht verformbar und leiten den elektrischen Strom.

Aluminium
In anderen Eigenschaften unterscheiden sich Metalle erheblich voneinander.
Man unterteilt beispielsweise Leicht- und Schwermetalle. Recherchiere im Internet und finde für diese Metallunterscheidung jeweils drei Beispiele und erörtere, warum bzw. wie man diese unterscheidet.
Leichtmetalle:
Schwermetalle:
Unterschiede:
Edle und unedle Metalle
Von großer Bedeutung ist auch die Unterscheidung in edle und unedle Metalle.
Man betrachtet hierfür das Reaktionsverhalten der Metalle. Edle Metalle sind all jene, die korrosionsbeständig sind. Unedle Metalle hingegen reagieren mit dem Luftsauerstoff, sie oxidieren (korrodieren). Eisen rostet hierbei durch, während andere unedle Metalle wie Aluminium sich lediglich mit einer Oxidschicht überziehen, die dann das restliche Metall vor weiterer Oxidation schützt (Passivierung).
Edelmetalle reagieren zudem nicht mit Salzsäure, während sich unedle Metalle unter Wasserstoffbildung auflösen.
Säuren lösen Metalle

Tropfe konzentrierte Salzsäure auf ein Stück Aluminiumfolie und beobachte die starke Reaktion, die nach kurzer Zeit eintritt.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Metallbindung
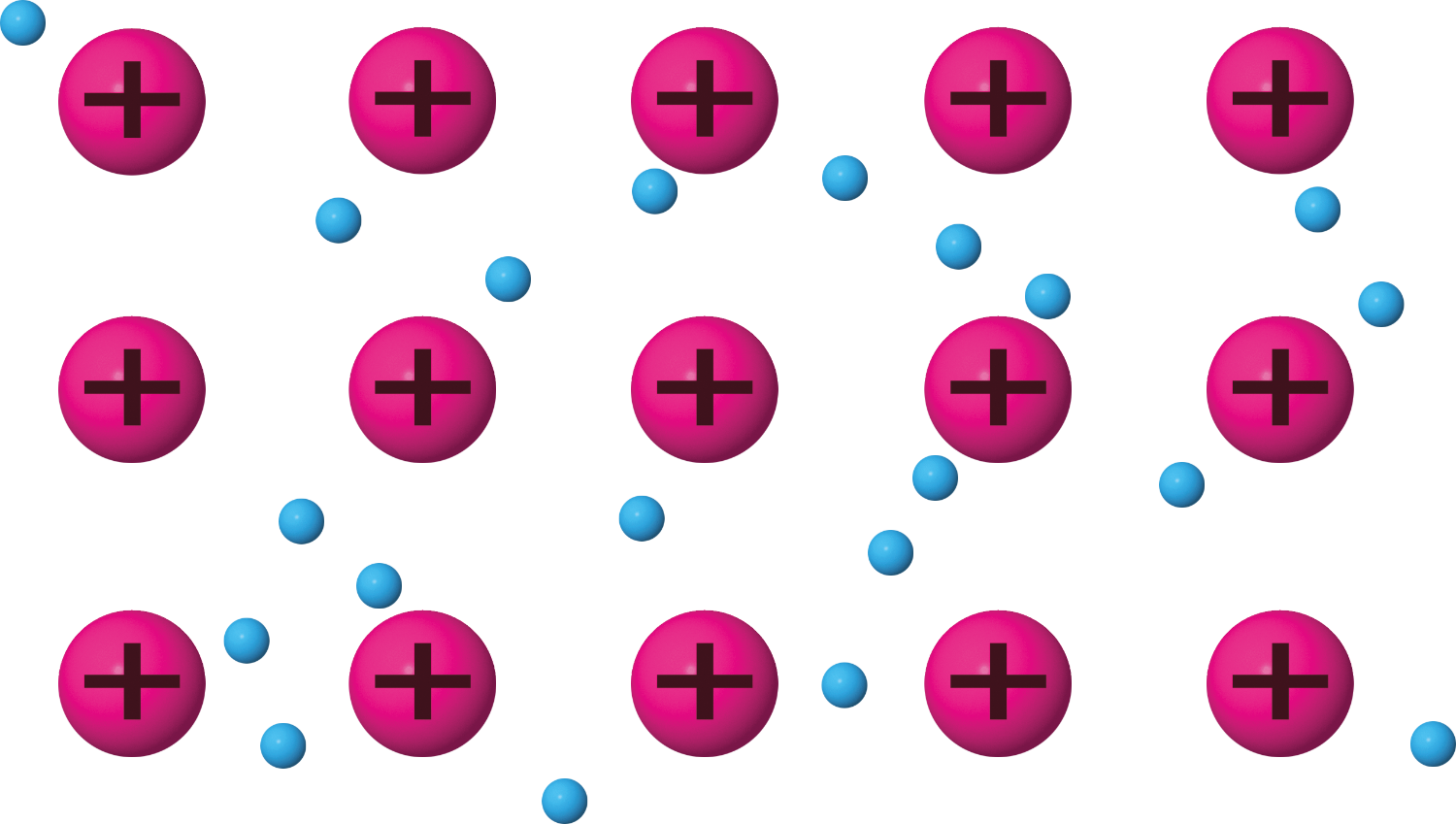
Bei der Metallbindung gibt jedes Atom seine Valenzelektronen ab. Es entstehen positiv geladene Metallkationen (sogenannte Atomrümpfe). Die abgegebenen Elektronen sind frei beweglich und bilden das sogenannte Elektronengas, das eine Abstoßung zwischen den Metallkationen verhindert und so das Metallgitter fest zusammenhält.
Die Zusammensetzung des Metallgitters gibt man mit einer chemischen Formel an, die die kleinstmögliche Einheit beschreibt. Setzt sich das Metall nur aus Na-Atomen zusammen, so reicht es, das Elementsymbol zu schreiben: Na. Das bedeutet, dass dieses Metall zu 100 % aus Na-Atomen gebildet ist.

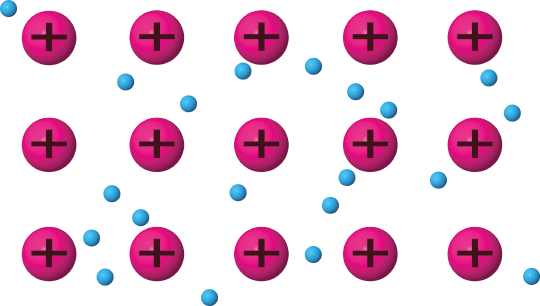
Überlege, welche der gegebenen Verbindungen Reinmetalle sind.
Nenne ihre chemische Formel.
Legierungen
Entstehung von Legierungen
Verbinden sich Metallatome von mindestens zwei verschiedenen Metallen miteinander, so erhält man eine Legierung. Die meisten metallischen Werkstoffe sind keine reinen Metalle, sondern aus verschiedenen Metallen zusammengesetzt. Man kann so die Eigenschaften der entstehenden Verbindung verändern. Man kann Metalle z. B. härter, dehnbarer, korrosionsbeständiger machen oder ihre Farbe ändern.
Informiere dich über zumindest drei Legierungen und ihre Verwendungen.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Chemischen Formel von Legierungen
Die Zusammensetzung einer Legierung erkennt man an ihrer chemischen Formel. An erster Stelle steht der Hauptbestandteil, dann folgen die weiteren Bestandteile. Bronze wird demnach mit der Formel CuSn beschrieben, da sie mehrheitlich aus Kupfer besteht. Wie viel Kupfer sich tatsächlich in der Verbindung befindet, kann variieren. Für gewöhnlich enthalten Bronzen mindestens 60 % Cu.

Überlegt im Team, warum Gold-Medaillen-Gewinner oft in ihre Medaillen beißen.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Bronze
Für Bronze mischt man Kupfer- und Zinn-Atome in der Schmelze. Das entstehende Metallgitter ist durch die unterschiedlichen Atomgrößen schwerer verschiebbar. Bronze ist nicht so gut verformbar wie ihre reinen Ausgangsmetalle. Bronze ist härter als Kupfer bzw. Zinn.
Erläutere, welches der gegebenen Bilder das Metallgitter von Bronze darstellt und begründe.
Begründung:
Training

Poliere ein Stück Aluminium mit Stahlwolle. Notiere die Unterschiede zwischen der polierten Stelle und der restlichen Oberfläche. Erwärme die polierte Stelle mit dem Brenner und untersuche, nach dem Abkühlen, die polierte Stelle ein zweites Mal. Beschreibe deine Beobachtung und gib eine Vermutung ab.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Materialeigenschaften
Vergleiche drei Metallproben, ein Stück Kupferdraht, ein Magnesiumband und einen Eisennagel. Erstelle eine Tabelle und notiere folgende Eigenschaften: Farbe, elektrische Leitfähigkeit, Wärmeleitfähigkeit, Verformbarkeit und Korrosionsbeständigkeit gegenüber Salzwasser. Plane die Experimente (Achtung: Magnesium ist brennbar), um nachvollziehbare Ergebnisse zu erhalten. Vergleiche deine Ergebnisse mit einer Mitschülerin, einem Mitschüler.
| Stoff | Kupfer | Magnesium | Eisen |
|---|---|---|---|
| Farbe | |||
| Elektrische Leitfähigkeit | |||
| Wärmeleitfähigkeit | |||
| Verformbarkeit | |||
| Korrosionsbeständigkeit |
Ordne die gegebenen Begriffe den passenden Beschreibungen zu.
Glanz, magnetisch, Dichte, Edelmetall, Aluminium, Eisen, Legierung, Stahl, Quecksilber, Erze, Leitfähigkeit, Schwermetall
beständig • Gold • Salzsäure • wertvoll
flüssig • giftig • Amalgam • Thermometer
Gesteine • Metalloxide • Verbindungen • Natur
Dichte • wiegen • Osmium • Gold
Strom • Elektronen • Elektrizität • Ionen
Eisen • Kobalt • Nickel • Anziehung
Masse • Volumen • schwer • leicht
Eisen • Kohlenstoff • Werkstoff • Legierung
Gemisch • Metalle • Messing • Bronze
Folie • silbrig • Leichtmetall • Fahrräder
magnetisch • Stahl • Rost • Erz
Schimmer • Licht • hell • Silber

Lies die Aussagen der Jugendlichen genau durch.
Entscheide, ob die Aussagen richtig oder falsch sind.
„Metalle sind super Stromleiter und verbiegen kann man sie auch.“
„Die Elektronen machen das, leider rosten immer gleich alle Metalle sofort.“
„Das liegt an den freien Neutronen. Die Neutronen sind für die Leitfähigkeit verantwortlich.“
„Gold rostet nicht, es ist sehr edel. Dafür kostet es auch genug.“
Formuliere eigene Aussagen zur Metallbindung und beschreibe die Eigenschaften möglichst genau. Diskutiere deine Ergebnisse mit einer Mitschülerin, einem Mitschüler. Verwende die Fachbegriffe: Valenzelektronen – Metallrümpfe – Legierung – oxidieren
Merke
Metallen und Legierungen – Zusammenfassung
In Metallen und Legierungen liegen die Metallatome als positiv geladene Atomrümpfe vor, die durch das Elektronengas zusammengehalten werden. Metalle zeigen typische Eigenschaften wie Glanz, Verformbarkeit und elektrische Leitfähigkeit. Durch Legierungsbildung lassen sich diese Eigenschaften ändern.