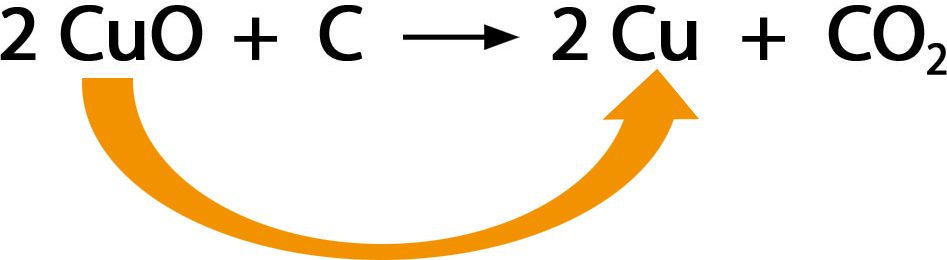Redox-Reaktionen
Inhalt
Oxidationen
Begriff Oxidation
Das Wort Oxidation leitet sich eigentlich von einem Irrtum ab. Der französische Chemiker Antoine Lavoisier glaubte nämlich ursprünglich, Säuren hätten als wesentliches Merkmal Sauerstoff (griech. oxys = sauer, scharf ). Erst später wurde erkannt, dass Säuren ganz anders definiert werden (siehe Kapitel 4.5). Der Begriff Oxidation wird auch heute noch für Reaktionen mit Sauerstoff verwendet und die entstehenden Verbindungen von Stoffen mit Sauerstoff werden Oxide genannt.
Brennt Metall?
Haltet ein Stück Magnesiumband mit einer Tiegelzange und erhitzt es über einem Brenner so lange, bis es sich entzündet. Achtung: Das Licht ist sehr grell. Legt die entstandene Asche auf eine feuerfeste Unterlage und beobachtet sie genau. Untersucht, welche Eigenschaften der neu entstandene Stoff besitzt.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Was sind Oxidationen?
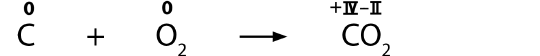
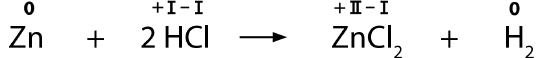
 Heute weiß man, dass nicht nur Reaktionen mit Sauerstoff Oxidationen sind. Bei Oxidationen gibt der Stoff, der oxidiert wird, Elektronen ab. Die angeführten Reaktionsgleichungen verdeutlichen das. Sauerstoff oxidiert Magnesium, Magnesiumoxid entsteht. Chlor oxidiert Natrium, Natriumchlorid (Kochsalz) entsteht. Was ist geschehen? Magnesium gibt seine zwei Valenzelektronen dem Sauerstoff. Als -Ion geht es Bindungen mit -Ionen ein. Natrium gibt sein Valenzelektron dem Chlor. Als -Ion geht es Bindungen mit -Ionen ein. Oxidationen laufen wie alle chemischen Reaktionen unterschiedlich schnell ab. Bei Oxidationen unterscheidet man zwischen jenen, die eine Flammenerscheinung zeigen und jenen, die dies nicht tun. Oxidationen mit Flammen sind schnell. Oxidationen ohne Flammen langsam.
Heute weiß man, dass nicht nur Reaktionen mit Sauerstoff Oxidationen sind. Bei Oxidationen gibt der Stoff, der oxidiert wird, Elektronen ab. Die angeführten Reaktionsgleichungen verdeutlichen das. Sauerstoff oxidiert Magnesium, Magnesiumoxid entsteht. Chlor oxidiert Natrium, Natriumchlorid (Kochsalz) entsteht. Was ist geschehen? Magnesium gibt seine zwei Valenzelektronen dem Sauerstoff. Als -Ion geht es Bindungen mit -Ionen ein. Natrium gibt sein Valenzelektron dem Chlor. Als -Ion geht es Bindungen mit -Ionen ein. Oxidationen laufen wie alle chemischen Reaktionen unterschiedlich schnell ab. Bei Oxidationen unterscheidet man zwischen jenen, die eine Flammenerscheinung zeigen und jenen, die dies nicht tun. Oxidationen mit Flammen sind schnell. Oxidationen ohne Flammen langsam.
Ordne zu, welche der gegebenen Oxidationen schnell und welche langsam sind.
Oxidation von Kupfer
Erhitze eine Cent-Münze mit dem Brenner, bis die Münze glüht, und lass die Münze auf einer feuerfesten Unterlage abkühlen. Beobachte die Veränderung.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Reduktionen
Was sind Reduktionen?
Reduktionen sind das Gegenteil von Oxidationen. Bei Reduktionen werden keine Elektronen abgegeben, sondern es werden Elektronen aufgenommen. Ein Beispiel für eine Reduktion ist die Reaktion von Kupferoxid zu Kupfer:

Reduktion von Kupfer

Nimm eine oxidierte Cent-Münze (dunkel angelaufen) und lege sie in ein Becherglas mit in Wasser aufgelöster Citronensäure. Beobachte die Veränderung.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Bedeutung von Reduktionen
Reduktionen haben große wirtschaftliche Bedeutung. Die Gewinnung von Metallen aus ihren oxidischen Erzen und das Galvanisieren, das Überziehen von Metallgegenständen mit einer edleren, schützenden Metallschicht, sind Beispiele dafür.
Verkupfern
Verbinde eine Cent-Münze mit dem Pluspol (Anode) einer Gleichspannungsquelle von 12 Volt und den Minuspol (Kathode) mit einer 20-Cent-Münze. Tauche die Münzen in ein Becherglas mit aufgelöster Citronensäure und schalte die Spannungsquelle ein. Beobachte das Experiment über eine ganze Schulstunde. Beschreibe, wie sich die Gegenstände verändert haben.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Redox-Reaktionen
Oxidationen und Reduktionen treten immer gemeinsam auf. Ein Reaktionspartner gibt Elektronen ab, ein anderer Reaktionspartner nimmt sie auf. Man spricht von Redox-Reaktionen (Reduktions-Oxidations-Reaktionen).
Manchmal ist die Reduktion die Reaktion, die von Bedeutung ist, manchmal die Oxidation, manchmal beides. Insgesamt stellen Redox-Reaktionen die Grundlage für die chemische Energiespeicherung und Energieumwandlung dar. Sie spielen in der Technik bei Batterien, Akkumulatoren, Brennstoffzellen oder Elektrolysen eine Rolle. Sie sind in der Natur bei Photosynthesen oder Gärungen wichtig.
Fülle in ein Becherglas gesättigte Salzlösung.
Diese dient als Elektrolyt. Baue einen Stromkreis mit einem Kohlestab (Pluspol), einer Leitung zu einem Solarmotor und einer zweiten Leitung zu einem Stück Magnesiumband (Minuspol). Tauche den Kohlestab und das Magnesiumband in den Elektrolyten. Beschreibe deine Beobachtung.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Training

Lies die Aussagen der Jugendlichen genau.
Markiere die Antworten, die dir richtig erscheinen und begründe deine Meinung. Formuliere eine eigene Aussage zur Redox-Reaktion und erläutere deine Meinung in einer Diskussion in der Klasse.
„Die Reaktion von Eisen mit Sauerstoff ist eine Oxidation.“
Begründung:
„Die Reaktion von Eisen mit Schwefel ist eine Sulfidation (Sulfid kommt von Schwefel).“
Begründung:
„Eisen wird oxidiert und Sauerstoff reduziert.“
Begründung:
„Eisenoxid und Eisensulfid sind eine Ionenbindung und gehören zu den Salzen.“
Begründung:
Meine Aussage:
Schnelle und langsame Oxidation
Ergänze die fehlenden Buchstaben, bevor du das Experiment durchführst.
Du b t zwei gleich große Proben Stahlwolle, ungefähr so groß wie ein Tischtennisball. Gib eine Probe in ein Becherglas mit Wasser und s e sie beiseite. Die zweite P e hältst du mit einer Tiegelzange über eine feuerfeste Unterlage. Entzünde die Stahlwolle. Achtung: Brennende S e wird sehr heiß. Nimm die Probe nach dem Abkühlen g u unter die Lupe. Beobachte auch die zweite Probe im W r. Beschreibe die Beobachtungen und stelle V n auf, ob es Ähnlichkeiten bei den Proben gibt.

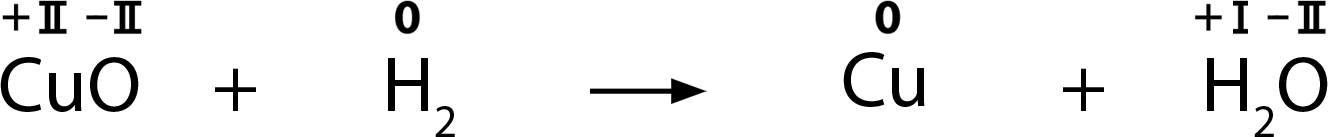
Oxidationszahlen geben an, ob ein Atom oxidiert oder
reduziert wird. Wenn die Oxidationszahl ansteigt, so handelt es sich um eine Oxidation. Wenn die Oxidationszahl abnimmt, so handelt es sich um eine Reduktion.
Array
Die Ermittlung der Oxidationszahlen ist nicht immer ganz einfach. In dem gegebenen Beispiel sind die Oxidationszahlen deshalb bereits in römischen Zahlen angeschrieben.
Gib an, wo die Oxidation und wo die Reduktion stattfindet.


Innere Struktur eines Abgaskatalysators
Finde heraus, welche chemischen Reaktionen in Abgaskatalysatoren von Autos ablaufen.
Gib an, welches Material und welche Strukturen die chemischen Reaktionen erleichtern. Beschreibe die Unterschiede zwischen Benzin- und Dieselmotoren.
Verwende dafür Wörter folgende Wörter: aber, dagegen, nur bei/im …, im Gegensatz zu, auch bei, doch, sowohl … als auch, während
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Merke
Oxidation und Reduktion – Zusammenfassung
Reaktionen, bei denen Elektronen abgegeben werden, nennt man Oxidationen. Oxidationen können, müssen aber nicht, mit Sauerstoff stattfinden. Den Gegensatz bilden Vorgänge, bei denen Elektronen aufgenommen werden: Reduktionen. Da beide Reaktionen immer gekoppelt ablaufen, spricht man von Redox-Reaktionen.