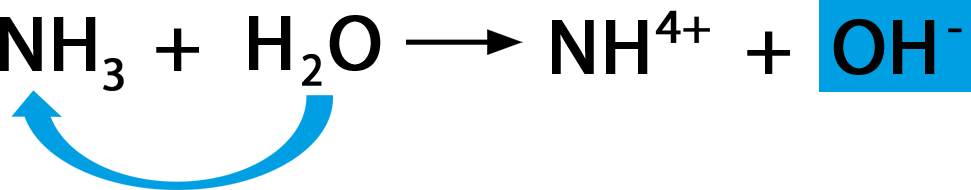Säure-Base-Reaktionen
Inhalt
Saure und basische Lösungen
Protolyse
Bei allen Säure-Base-Reaktionen werden Protonen übertragen. Säure-Base-Reaktionen nennt man deshalb auch Protolysen. Protonen sind Teilchen, die alle Säuren abgeben können. Alle Säuren beinhalten das Element Wasserstoff, das sie als H⁺, als positiv geladenes Wasserstoffion, als sogenanntes Proton abgeben können. Basen sind das Gegenteil von Säuren. Sie nehmen Protonen auf.

Überlege, warum man H⁺-Ionen Protonen nennt.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Hydroniumionen

Erst, wenn eine Säure in Wasser gegeben wird, kann sie Protonen (ans Wasser) abgeben. Die Wassermoleküle nehmen die H⁺ auf und werden zu H₃O⁺-Ionen, sogenannten Hydroniumionen. Liegen in einer wässrigen Lösung vermehrt H₃O⁺-Ionen vor, so spricht man von sauren Lösungen.
| Name | Formel | Vorkommen/Anwendung |
|---|---|---|
| Salzsäure | HCl(aq) | Magensaft, Erzaufbereitung, Beizen vom Metallen |
| Schwefelsäure | H2SO4(aq) | Düngemittel- u. Farbstoffherstellung, Elektrolyt in Bleiakkus |
| Kohlensäure | H2CO3(aq) | Getränke, Herstellung von Backtriebmittel u. Brausepulver |
| Essigsäure | CH3COOH(aq) | Speiseessig, Konservierungsstoff, Reinigungsmittel |
Befindet sich hinter einer Summenformel (aq), dann bedeutet das, dass dieser Stoff in aqua (Wasser) gelöst vorliegt.
Säure-Base-Reaktionen
saeure-basen-reaktionen.pdf · 33 kB
Erweitere die Tabelle mit folgenden Säuren:
Ameisensäure, Citronensäure, Phosphorsäure, Salpetersäure, Flusssäure …
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um eine Datei zu dieser Aufgabe hochzuladen.
Hydroxidionen
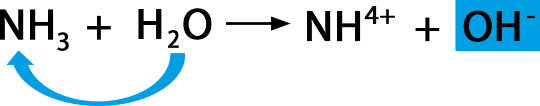
Gibt man eine Base in Wasser, so stellt man eine basische Lösung her, die auch oft Lauge genannt wird. Die Base nimmt von den H₂O-Molekülen H⁺-Ionen auf, OH⁻-Ionen, sogenannte Hydroxidionen, entstehen.
| Name | Formel | Vorkommen/Anwendung |
|---|---|---|
| Natronlauge | NaOH(aq) | Abflussreiniger, Laugengebäck, Chemische Industrie |
| Kalilauge | KOH(aq) | Abflussreiniger, Seifen-, Schmierstoff- u. Glasherstellung |
| Ammoniaklösung | NH3(aq) | Reinigungsmittel, Düngemittelherstellung |

Natriumhydroxid
Löschkalk ist eine weitere wichtige Base.
Finde heraus, welche Formel die Verbindung hat und wozu sie verwendet wird.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
pH-Wert
Was ist der pH-Wert?
Der sogenannte pH-Wert gibt an, wie stark sauer oder basisch eine wässrige Lösung ist. Der Name leitet sich vom Lateinischen pondus hydrogenii ab, was so viel wie Gewicht des Wasserstoffs bedeutet. Der pH-Wert ist somit eine Maßzahl, die angibt, wie hoch die Konzentration an H⁺-Ionen (bzw. H₃O⁺) in wässriger Lösung ist.
In reinem Wasser befinden sich fast nur Wassermoleküle.
Nur ein Molekül von 500 Millionen zerfällt in H⁺-Ion und OH⁻-Ion. Damit enthält es aber gleiche viele H⁺-Ionen wie OH⁻-Ionen und ist neutral.

Saure und basische Lösungen
Saure und basische Lösungen leiten elektrischen Strom Stelle zwei saure und zwei basische Lösungen mit unterschiedlicher Konzentration her, du kannst z. B. die Menge der zugesetzten Chemikalien bei der zweiten Lösung verdoppeln. Fülle eine Lösung nach der anderen in ein Becherglas und bestimme mit einem Vielfachmessgerät den elektrischen Widerstand der Lösung. Notiere die Messwerte und worauf du achten musst, damit die Messung nachvollziehbar bleibt.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
pH-Wert von Säuren und Basen
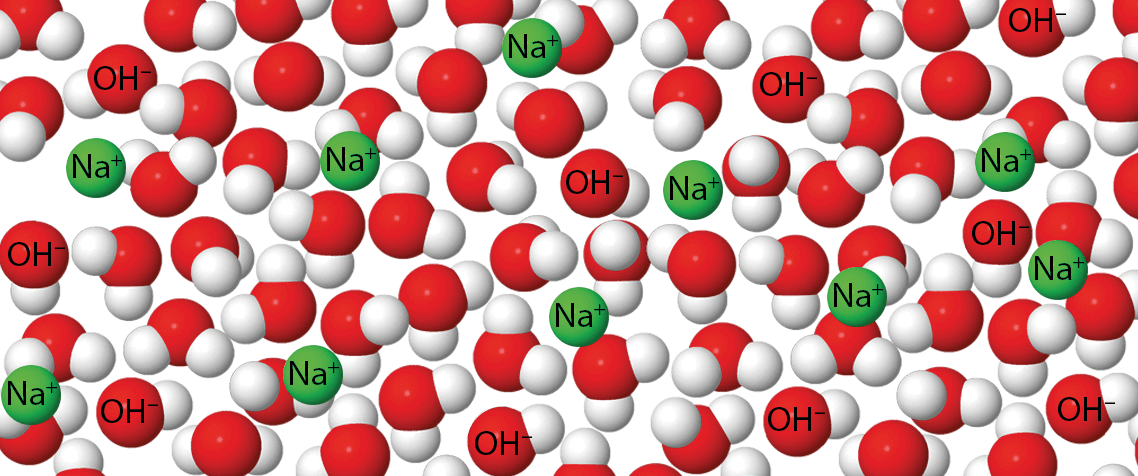
Saure Lösungen enthalten mehr H₃O⁺-Ionen als OH⁻-Ionen. Der pH-Wert saurer Lösungen ist kleiner als 7. Neutrale Lösungen enthalten gleich viele H₃O⁺-Ionen wie OH⁻-Ionen. Der pH-Wert neutraler Lösungen ist 7. Basische Lösungen enthalten mehr OH⁻-Ionen als H₃O⁺-Ionen. Der pH-Wert basischer Lösungen ist größer als 7.

Beschreibe das Bild.
Verwende dafür auch die folgenden Begriffe: Hydroxidionen, Wasser, pH-Wert, 7
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Training
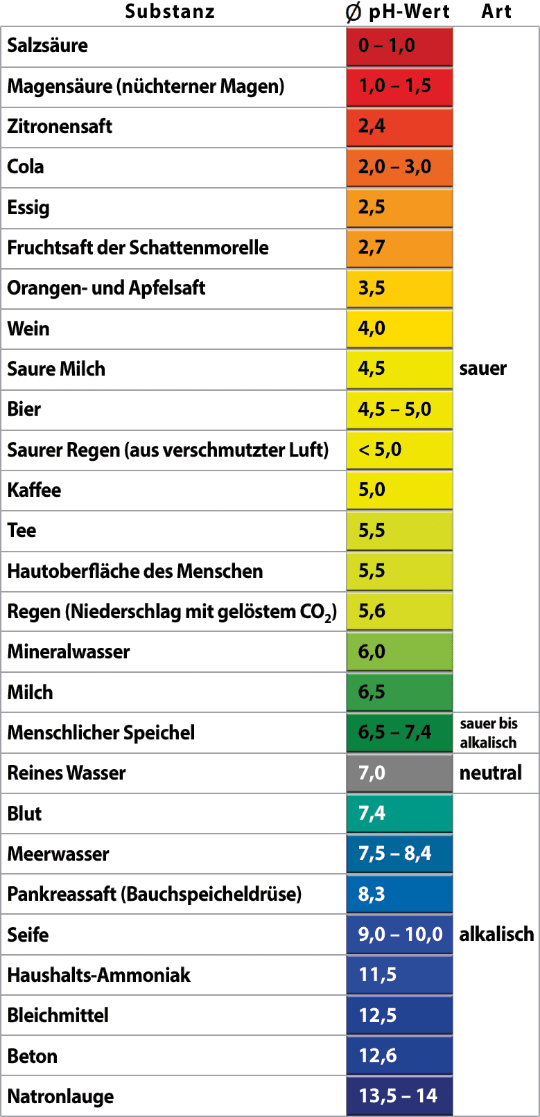
Stoffe nach pH ordnen
pH im Meer
Der größte Lebensraum der Erde, das Meer, hängt ganz entscheidend von einem stabilen pH-Wert ab.
Recherchiere, wie sich der pH-Wert verändert.
Schreibe die Formel der wichtigsten Reaktion an, die aktuell zu einer Versauerung der Meere führt.
Erläutere, welche Konsequenzen das für die Meeresbewohner hat und wie sich das letztlich auf Dein Leben auswirken kann.
Wichtige Säuren und Basen
Überlege, welche der gegebenen Säuren organisch und welche anorganisch sind.
| organisch | anorganisch | |
|---|---|---|
| HCl | ||
| H₂SO₄ | ||
| HNO₃ | ||
| H₂CO₃ | ||
| CH₃COOH | ||
| H₃PO₄ | ||
| HCOOH |
Alle Säuren enthalten mindestens ein Wasserstoffatom, das sie als Proton abgeben können.
Salzsäure (HCl) hat ein Wasserstoffatom, Schwefelsäure (H₂SO₄) hat zwei. Säuren, die eine Carboxylgruppe (-COOH) besitzen, nennt man Carbonsäuren, und diese sind organische Säuren. Organische Säuren geben Wasserstoff als Proton nur von dieser Gruppe ab.
Gib an, wie viele Wasserstoffatome die folgenden Säuren als Protonen abgeben können.
HNO₃
H₂CO₃
CH₃COOH
H₃PO₄

HCOOH
Säuren können lebensgefährlich sein;
sie können aber auch angenehm sauer schmecken und erfrischen.
Ordne die Säuren richtig zu.
Recherchiere, wenn nötig, im Internet.
ätzend und lebensgefährlich
ätzend, in entsprechender Verdünnung ungefährlich
harmlos, kann in kleineren Mengen genossen werden
Merke
Säuren und Basen – Zusammenfassung
Säuren sind Stoffe, die in Wasser gelöst die Hydroniumionen-Konzentration erhöhen. Basen sind Stoffe, die in Wasser die Hydroxidionen-Konzentration erhöhen. Der pH-Wert einer wässrigen Lösung gibt an, wie stark sauer oder basisch die Lösung ist.