Sauer, basisch, neutral
Inhalt
pH-Meter und Indikatoren
pH-Meter
Der pH-Wert von wässrigen Lösungen kann mithilfe von pH-Metern oder Indikatoren ermittelt werden. Das Bild zeigt ein pH-Meter; der pH-Wert wird hier auf elektrochemischem Wege exakt gemessen. Säure-Base-Indikatoren können für eine grobe pH-Messung verwendet werden.

Schreibe den Schlangensatz richtig in das Feld.
Füge die Leerzeichen und Satzzeichen ein! Beachte die Groß- und Kleinschreibung!
DERBEGRIFFINDIKATORSTAMMTVOMLATEINISCHENWORTINDICAREAB.DASBEDEUTETETWASOVIELWIEANZEIGEN.DIEINDIKATORENINDERCHEMIEZEIGENDURCHFARBUMSCHLAGZUMEISPIELDENPHWERTEINERLÖSUNGAN.
Natürliche Indikatoren
Man findet in der Natur eine Reihe von Farbstoffen, die sich als natürliche Indikatoren eignen. Im Rotkraut sind diese Indikatoren Anthocyane. Sie zeigen im basischen Bereich eine blaue, im sauren eine rote Farbe. Je nach pH-Wert des Bodens wächst dann entsprechend eher Rotkraut oder eher Blaukraut.
Naturstoffe als Indikatorlösung

Du benötigst verdünnten Rotkrautsaft als Indikatorlösung, Schnappdeckelgläser und Pipetten. Proben sind Zitronensaft, Haushaltsessig, Leitungswasser, Kernseife in Spiritus, Kernseife in Wasser, Kaisernatron-Lösung, Vollwaschmittel-Lösung und Soda-Lösung. Fülle in ein Glas 2 cm verdünnten Rotkrautsaft und gib zwei bis drei Tropfen einer Probe hinzu. Wiederhole den Vorgang mit allen Proben und vergleiche die Farbveränderungen des Rotkrautsaftes.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Universalindikatoren
Natürliche Indikatoren sind nicht lange haltbar. In Laboren verwendet man daher synthetisch hergestellte, reine Farbstoffe.
Oft kommen auch Universalindikatoren zum Einsatz. Darunter versteht man eine Mischung von Indikatoren, die mit unterschiedlichen Farben anzeigen, wie sauer oder wie basisch eine Lösung ist. Universalindikatoren mit Farbskala gibt es als Flüssigkeit, Papier oder Stäbchen.

pH-Wert von Lebensmittel
Teste mit einem pH-Teststreifen den pH-Wert von Lebensmitteln. Überlege dir, welche Lebensmittel sich sofort zum Testen eignen und welche du vorher aufbereiten musst.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Neutralisation
Säuren und Basen können gefährlich sein
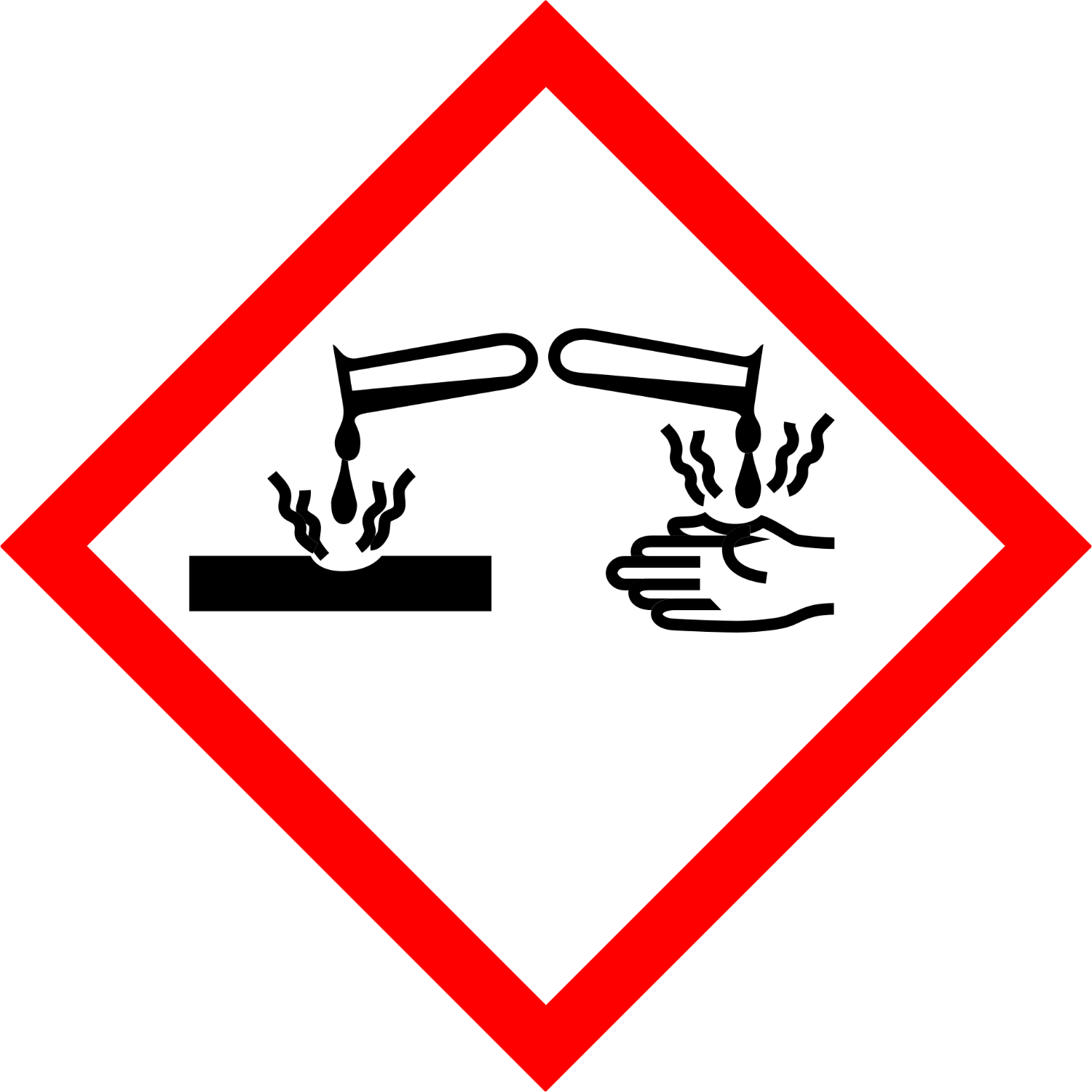
Alle sauren und basischen Lösungen sind mehr oder weniger stark ätzend und somit gefährlich. Es kommt natürlich sehr auf die Konzentration, aber auch die Art der Säure oder Base an. Anorganische Stoffe und organische Stoffe können angegriffen werden – dies wird auch im Gefahrenpiktogramm gezeigt.

Gefahrenzeichen „ätzend“
Dieses Symbol warnt, dass ein chemischer Stoff auf Metalle korrosiv wirken, hautätzend ist oder schwere Augenschädigung verursacht. Teil des „Global harmonisierten Systems zur Einstufung und Kennzeichnung von Chemikalien“.

Teste die Wirkungen von Säuren auf unterschiedliche Materialen.
Gib jeweils einen Tropfen verdünnte Salzsäure, Schwefelsäure und Salpetersäure nebeneinander auf die Materialproben. Verwende Materialproben von Kalk, Aluminium, Kupfer, Stahl, Baumwolle u.a.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Verdünnen und neutralisieren
Verdünnt man eine saure oder basische Lösung mit Wasser, so wird sie immer weniger sauer bzw. basisch. Aber neutralisieren kann man so nichts.
Veränderung der Konzentration
Fülle eine saure Lösung 1 cm hoch in ein Reagenzglas und miss den pH-Wert. Ergänze die Lösung mit 1 cm destilliertem Wasser und miss wieder den pH-Wert. Wiederhole den Vorgang, bis das Reagenzglas voll ist. Notiere deine Beobachtung und Vermutung.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Neutralisationsreaktion
Mischt man saure und basische Lösungen, so entstehen immer Salz und Wasser. Kommen genauso viele H⁺-Ionen wie OH⁻-Ionen zusammen, so heben sich diese Ionen in ihrer Wirkung auf. Sie neutralisieren einander. Man nennt dies deshalb auch eine Neutralisationsreaktion, obwohl das entstehende Salzwasser nicht neutral sein muss. Es kommt auf das entstehende Salz an, ob die Lösung sauer, neutral oder basisch ist.
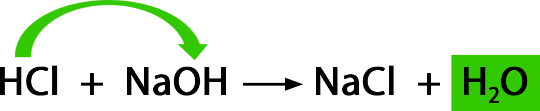

Neutralisation
Fülle in ein Reagenzglas verdünnte Salzsäure, wie sie auch im Magen vorkommt und bestimme den pH-Wert. Füge mit einem Spatel langsam Basenpulver hinzu, bis die Lösung pH neutral ist. Überprüfe den pH-Wert durch ständiges Messen. Du kannst auch eine Indikatorflüssigkeit verwenden.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Training
phet.colorado.edu
pH Skala
https://phet.colorado.edu/sims/html/ph-scale/latest/ph-scale_de.html
Verwende die Simulation "pH Skala", um den pH-Wert von verschiedenen Flüssigkeiten herauszufinden!
Künstliche oder natürliche Farbstoffe
Smarties und M&M’s werden gefärbt, eine Süßigkeit mit natürlichen und eine hingegen mit künstlichen Farbstoffen. Viele Farbstoffe können ihre Farbe „wechseln“, wenn du Säuren oder Laugen hinzufügst. Solche Farbstoffe werden gerne als Indikatorfarbstoffe zum Erkennen von sauren oder basischen Lösungen eingesetzt. Im folgenden Experiment sollst du diese Indikatoreigenschaft der Farbstoffe von Smarties bzw. M&M’s untersuchen.
Du benötigst Schnappdeckelgläser, eine weiße Unterlage, verdünnte Natronlauge, verdünnte Salzsäure, Smarties, M&M’s, destilliertes Wasser, kleine Bechergläser, eine Pinzette und eine Pipette. In 2 Schnappdeckelgläser gibst du je ein Smarties derselben Farbe sowie 1-2 Pipetten voll Wasser. Nach dem Entfernen des nun weißen Smarties mit der Pinzette tropfst du in ein Schnappdeckelglas 2-3 Tropfen Säure, in das andere 2-3 Tropfen Lauge.
Trage die Ergebnisse ein und wiederhole deine Versuche mit M&M’s.
| Farbe Smarties | Farbe Säure | Farbe Lauge | Farbe M&M’s | Farbe Säure | Farbe Lauge |
|---|---|---|---|---|---|
Beantworte die Fragen zum vorigen Experiment.
Welche Smarties-Farben sind gut zum Erkennen von Säuren geeignet? Welche zum Erkennen von Laugen?
Säuren:
Laugen:
Beschreibe ganz allgemein, was du unter einem Indikator verstehst.
Welchen Farben würdest du diesbezüglich den Vorzug geben – den natürlichen Farbstoffen in den Smarties oder den künstlichen Farbstoffen in den M&M’s? Begründe deine Entscheidung.
Ich gebe den Vorzug:
Begründung:
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Schreibe mindestens zwei weitere Forscherideen auf.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Ergänze die Reaktionsgleichungen.
Denke an die Neutralisation.
Info: Sofern dein Browser moderne Schriftsätze unterstützt, erscheinen Zahlen, die du in die Formel-Felder eingibst, automatisch tiefgestellt.
Was gehört zusammen?
Neutralisation
Fülle in ein kleines Becherglas 5 ml verdünnte Salzsäure und wenige Tropfen einer Universalindikatorlösung. Füge verdünnte Natronlauge hinzu, bis sich die beiden Lösungen neutralisiert haben. Beachte, dass kurz vor der Neutralisation nur mehr ganz geringe Mengen der Natronlauge hinzugefügt werden dürfen. Überlege dir, wie du die Natronlauge genau dosieren kannst. Welche Hilfsmittel kannst du verwenden? Überlege, welche Produkte sich bilden. Stelle die entsprechende Reaktionsgleichung für das Experiment auf.
Du bist nicht angemeldet.
Registriere dich oder melde dich an, um deinen Text zu dieser Aufgabe zu speichern.
Merke
Der pH-Wert kann mit pH-Metern oder Indikatoren ermittelt werden. Der pH-Wert kann durch Wasserzugabe verändert werden. Neutralisation kann nur erfolgen, wenn saure und basische Lösungen reagieren. Es entsteht Salz und Wasser.